2021年2月19日,由君实生物自主研发的抗PD-1单抗药物特瑞普利单抗注射液(拓益®)获得国家药品监督管理局(NMPA)批准,用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌(NPC)患者的治疗,成为全球首个获批鼻咽癌治疗的抗PD-1单抗,实现了该领域内免疫治疗零的突破。
* {9 o3 O1 G' T) Q( @$ Z2 F鼻咽癌免疫治疗获突破
; @ P7 e9 N. L+ e1 s) `# H) M+ m
鼻咽癌(NPC)是一种原发于鼻咽部黏膜上皮的恶性肿瘤,为我国常见的头颈肿瘤之一。分布具有鲜明的地域性特征,在中国南部(如广东、广西等)尤其高发1。2020年全球有13.3万新发病例2,其中中国的新发病例约占全球一半3。此外在全球范围内,中国的鼻咽癌死亡病例数也位居第一4。
9 r N6 P3 l7 R1 K. H; A/ g
放化疗是鼻咽癌治疗的主要手段,对于复发转移性鼻咽癌的治疗通常采用以铂为主的化疗方案。如,对于转移性鼻咽癌的一线治疗首推顺铂+吉西他滨的联合化疗方式,二线或三线的治疗则以卡培他滨或多西他赛单药维持5。
# _: X% J" ^/ l0 x8 p
靶向治疗在鼻咽癌的治疗上存在较大空缺,而免疫治疗也仅仅作为二线治疗的三级推荐,虽有临床研究证实其有效性,但尚未真正用于规范的临床治疗当中。因此,复发/转移性鼻咽癌患者的预后往往不是十分乐观。
( c" X1 T* D+ t* Z/ F W/ z" w基于此,君实生物充分结合了我国鼻咽癌患者的特点进行了名为POLARIS-02的研究(NCT02915432)。并凭此研究一举获得了国家药品监督管理局的批准,成为了全球首个获批的鼻咽癌免疫治疗疗法。这意味着从此,复发转移性鼻咽癌患者在治疗时将拥有新的选择,也可借此获得更好的生存获益。
! `! Q4 h1 [# q) Z$ y- C! d
POLARIS-02研究
- D2 k# K3 Z6 [# n% A
研究设计
2016年12月至2019年2月,POLARIS-02研究在国内17家研究中心入组了190例既往接受过全身系统化疗失败的RM-NPC患者(≥18岁),接受特瑞普利单抗单药治疗(3mg/kg,IV,Q2W)。这也是迄今为止全球范围内已完成的最大规模的免疫检查点抑制剂单药治疗复发或转移性鼻咽癌的临床试验。
' L/ C" `$ z$ ^! S
该研究的主要终点为客观缓解率(ORR),次要终点包括缓解持续时间(DOR)、无进展生存期(PFS)和总生存期(OS)。
! D# V( a& D' j& ]% K0 i. n; O u研究结果
截至2020年02月19日,所有190例患者中,观察到5例CR、34例PR、40例SD,客观缓解率(ORR)为20.5%,疾病控制率(DCR)为41.6%6。
7 c7 N+ A7 @! u" e9 Z* E( y; \! s
3 V: N0 c4 t7 I- T, v% g/ X中位缓解持续时间(DOR)为12.8个月,缓解维持时间较持久;中位PFS为1.9个月,中位OS为17.4个月6。有将近一半的患者肿瘤出现退缩(45.6%),缩小≥30%的占到30%。
; s( f# j6 K/ e
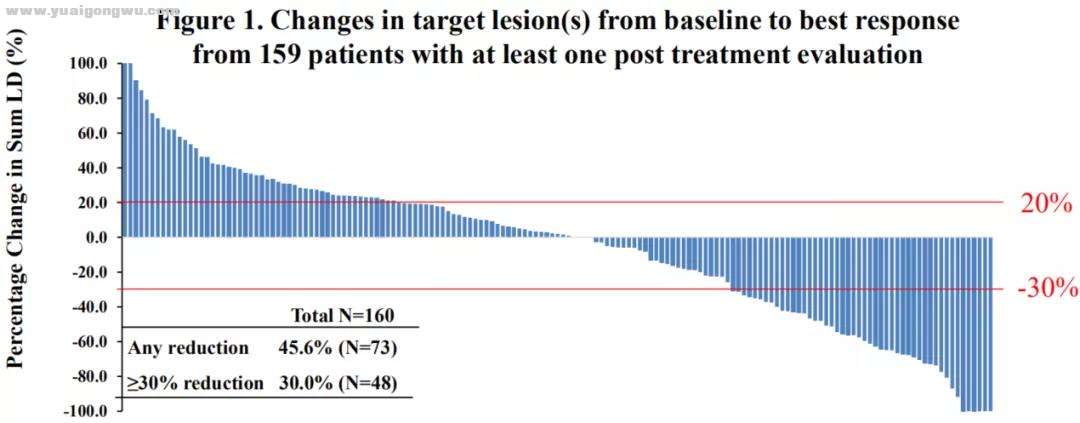 . |( H# a# f" X
. |( H# a# f" X 至少一次治疗后评价的160例患者的靶病灶自基线到最佳疗效的变化
9 h0 c' Z0 G2 L7 j
% K& g( d5 Q7 t/ A
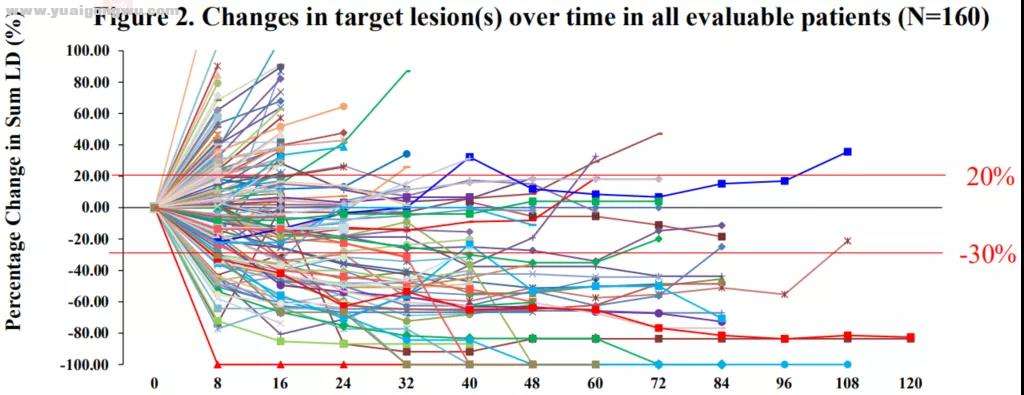
所有可评估患者的靶病灶随时间的变化
5 j/ E/ E" q4 _: W
此外,在92例接受过至少二线系统化疗失败的复发/转移性鼻咽癌患者中,特瑞普利单抗单药治疗的客观缓解率(ORR)为23.9%,疾病控制率(DCR)为41.3%,中位总生存时间(mOS)达到15.1个月,中位缓解持续时间(mDOR)达到14.9个月7。
9 X4 }" v- u9 C% X安全性
在全部190例受试者中共有176例(92.6%)患者出现治疗相关不良事件(TRAE)。大部分为2级以下的TRAE,最常见的TRAE为贫血、甲状腺功能减退、乏力、谷草转氨酶(AST)升高、蛋白尿和发热等。严重不良事件发生率较低,≥3级TRAE发生率为27.9%。
3 c8 Q& ]' ]; J不良反应发生类型及人数
8 B0 ^8 h0 N( X小结
特瑞普利单抗在针对复发/转移性鼻咽癌患者的治疗中表现出持久的抗肿瘤活性和生存获益,安全性可控,且无论患者PD-L1表达如何,均可获益。
4 E7 \! I+ _/ h+ U
特瑞普利单抗的更多可能
# f6 b0 v) L. o( c+ M
特瑞普利单抗注射液(拓益®)是我国批准上市的首个国产以PD-1为靶点的单抗药物,先前已获批用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗,在《中国临床肿瘤学会(CSCO)2020黑色素瘤诊疗指南》中获得了推荐,并于2020年12月被纳入国家医保目录。如今特瑞普利单抗再次获批用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者的治疗。
6 L1 Q) i% D! U p1 o8 N在鼻咽癌领域,君实生物的研究已实现全线贯穿,全球布局。基于POLARIS-02研究,2020年9月,特瑞普利单抗用于鼻咽癌的治疗获得美国食品药品监督管理局(FDA)授予的突破性疗法认定,预计今年将就该适应症向FDA递交特瑞普利单抗的首个生物制品许可申请(BLA)。此外,君实生物还开展了一项特瑞普利单抗联合化疗一线治疗鼻咽癌的国际多中心III期临床研究(JUPITER-02研究),该适应症的上市申请已于今年2月获得NMPA受理。
& k3 U- T+ j! P) G4 L对于特瑞普利单抗的探索其实还远不止这些,自2016年初起,君实生物已在全球开展了30多项临床研究来探索特瑞普利单抗在黑色素瘤、鼻咽癌、尿路上皮癌、肺癌、胃癌、食管癌、肝癌、胆管癌、乳腺癌、肾癌等适应症的疗效和安全性。截至目前,特瑞普利单抗已获得1项突破性疗法认定(鼻咽癌),1项快速通道资格认定(黏膜黑色素瘤),以及3项孤儿药资格认定(黏膜黑色素瘤、鼻咽癌、软组织肉瘤)。
, V- T# [! K$ w; z' @! i让我们一起期待特瑞普利单抗的更多可能吧!
# T, ^9 _' j3 e+ u) y
8 Y) z9 u8 P5 A4 R